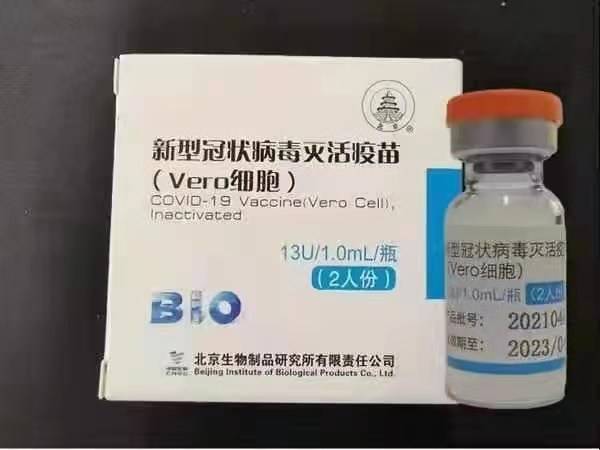
Sinopharm (ปักกิ่ง): BBIBP-CorV
ขั้นตอนที่ 1
1 ทดลอง
ChiCTR2000032459
จีน
เฟส 2
2 การทดลอง
NCT04962906
อาร์เจนตินา
ChiCTR2000032459
จีน
เฟส 3
6 การทดลอง
NCT04984408
ChiCTR2000034780
สหรัฐอาหรับเอมิเรตส์
NCT04612972
เปรู
NCT04510207
บาห์เรน อียิปต์ จอร์แดน สหรัฐอาหรับเอมิเรตส์
NCT04560881, BIBP2020003AR
อาร์เจนตินา
NCT04917523
สหรัฐอาหรับเอมิเรตส์
การอนุมัติ
รายชื่อใช้ในกรณีฉุกเฉินของ WHO 59 ประเทศ
แองโกลา、อาร์เจนตินา、บาห์เรน、บังกลาเทศ、เบลารุส、เบลีซ、โบลิเวีย(รัฐพหุนิยมของ)、บราซิล、บรูไนดารุสซาลาม、กัมพูชา、แคเมอรูน、ชาด、จีน、คอโมโรส、อียิปต์、อิเควทอเรียลกินี、กาบอง、แกมเบีย、จอร์เจีย、กายอานา、ฮังการี、ndo 、อิหร่าน (สาธารณรัฐอิสลาม)、อิรัก、จอร์แดน、คีร์กีซสถาน、สาธารณรัฐประชาธิปไตยประชาชนลาว
เลบานอน、มาเลเซีย、มัลดีฟส์、มอริเตเนีย、ออริเชียส、มองโกเลีย、มอนเตเนโกร、โมร็อกโก、โมซัมบิก、นามิเบีย、เนปาล、ไนเจอร์、มาซิโดเนียเหนือ、ปากีสถาน、ปารากวัย、เปรู、ฟิลิปปินส์、สาธารณรัฐคองโก、เนกัล、เซอร์เบีย、เซเชลส์、เซียร์ราลีโอน หมู่เกาะ、โซมาเลีย、ศรีลังกา、ไทย、ตรินิแดดและโตเบโก、ตูนิเซีย、สหรัฐอาหรับเอมิเรตส์、เวเนซุเอลา (สาธารณรัฐโบลิเวีย)、เวียดนาม、ซิมบับเว
Sinopharm BBIBP-CorV COVID-19 เป็นวัคซีนเชื้อตายที่ทำจากอนุภาคไวรัสที่เพาะเลี้ยงซึ่งไม่มีความสามารถในการทำให้เกิดโรค ผู้สมัครวัคซีนนี้ได้รับการพัฒนาโดย Sinoarm Holdings และสถาบันผลิตภัณฑ์ชีวภาพแห่งปักกิ่ง
วัคซีน Sinopharm BBIBP-CorV ทำงานโดยให้ระบบภูมิคุ้มกันผลิตแอนติบอดีต่อต้าน SARS-CoV-2 beta coronavirus วัคซีนเชื้อตายถูกใช้มานานหลายทศวรรษ เช่น วัคซีนป้องกันโรคพิษสุนัขบ้าและวัคซีนตับอักเสบเอ เทคโนโลยีการพัฒนานี้ประสบความสำเร็จในการประยุกต์ใช้วัคซีนที่มีชื่อเสียงมากมาย เช่น วัคซีนป้องกันโรคพิษสุนัขบ้า
สายพันธุ์ SARS-CoV-2 ของ Sinopharm (สายพันธุ์ WIV04 และหมายเลขไลบรารี MN996528) แยกได้จากผู้ป่วยที่โรงพยาบาล Jinyintan ในเมืองหวู่ฮั่น ประเทศจีน ไวรัสแพร่กระจายในการเพาะเลี้ยงในสายเซลล์ Vero ที่มีความสามารถ และส่วนเหนือตะกอนของเซลล์ที่ติดเชื้อถูกปิดใช้งานด้วย β-propiolactone (1:4000 vol/vol, 2 ถึง 8°C) เป็นเวลา 48 ชั่วโมง หลังจากการชี้แจงของเศษเซลล์และการกรองแบบอัลตราฟิลเตรชัน การยับยั้ง β-propiolactone ครั้งที่สองถูกดำเนินการภายใต้สภาวะเดียวกันกับการยับยั้งครั้งแรก จากข้อมูลของ WHO วัคซีนถูกดูดซับบนสารส้ม 0.5 มก. และบรรจุลงในหลอดฉีดยาแบบเติมล่วงหน้าในน้ำเกลือบัฟเฟอร์ฟอสเฟตปลอดเชื้อ 0.5 มล. โดยไม่มีสารกันบูด
เมื่อวันที่ 31 ธันวาคม 2563 องค์การยาแห่งรัฐได้ประกาศอนุมัติวัคซีนทดลองที่พัฒนาโดยสิโนแฟม
เมื่อวันที่ 7 พฤษภาคม พ.ศ. 2564 องค์การอนามัยโลกได้ประกาศอนุมัติวัคซีน รายชื่อการใช้ในกรณีฉุกเฉินของ WHO ทำให้ประเทศต่างๆ สามารถเร่งการอนุมัติตามกฎข้อบังคับของตนเองในการนำเข้าและดูแลวัคซีนโควิด-19 WHO Advisory Expert Group on Immunization Strategies ได้เสร็จสิ้นการทบทวนวัคซีนแล้ว จากหลักฐานที่มีอยู่ทั้งหมด WHO แนะนำให้ฉีดวัคซีนสองโดส ห่างกัน 3-4 สัปดาห์สำหรับผู้ใหญ่ 18 ปีขึ้นไป ประสิทธิภาพของวัคซีนป้องกันโรคตามอาการและการรักษาในโรงพยาบาลอยู่ที่ประมาณ 79% สำหรับทุกกลุ่มอายุรวมกัน
สมาคมการแพทย์อเมริกันได้ตีพิมพ์ "การทดลองทางคลินิกแบบสุ่ม: ผลของวัคซีน SARS-CoV-2 ที่ปิดใช้งาน 2 ตัวต่อการติดเชื้อ COVID-19 ที่มีอาการในผู้ใหญ่" เมื่อวันที่ 26 พฤษภาคม พ.ศ. 2564 โดยสรุปว่า "ในการวิเคราะห์ชั่วคราวที่กำหนดไว้ล่วงหน้าของการทดลองทางคลินิกแบบสุ่ม ผู้ใหญ่ วัคซีน SARS-CoV-2 ที่ยับยั้ง 2 ชนิดที่ฉีดในการวิเคราะห์ชั่วคราวที่กำหนดไว้ล่วงหน้าของการทดลองทางคลินิกแบบสุ่มช่วยลดความเสี่ยงของอาการ COVID-19 ที่แสดงอาการได้อย่างมีนัยสำคัญ และเหตุการณ์ไม่พึงประสงค์ที่ร้ายแรงนั้นพบได้ยาก" ในการทดลองแบบสุ่มระยะที่ 3 ในผู้ใหญ่นี้ ประสิทธิภาพของวัคซีนป้องกันไวรัสทั้งตัว 2 ชนิดที่ยับยั้งการทำงานของผู้ป่วยโควิด-19 ที่มีอาการเท่ากับ 72.8% และ 78.1% ตามลำดับ วัคซีน 2 วัคซีนมีเหตุการณ์ไม่พึงประสงค์ร้ายแรงที่หายากและมีความถี่ใกล้เคียงกับกลุ่มควบคุมสารส้มเท่านั้น และส่วนใหญ่ไม่เกี่ยวข้องกับการฉีดวัคซีน การวิเคราะห์เชิงสำรวจพบว่า วัคซีน 2 ตัวกระตุ้นแอนติบอดีที่ทำให้เป็นกลางที่วัดได้ คล้ายกับผลลัพธ์ของการทดลองระยะที่ 1/2
คณะทำงาน WHO SAGE เผยแพร่การทบทวนวัคซีน Sinopharm/BBIBP COVID-19 เมื่อวันที่ 10 พฤษภาคม พ.ศ. 2564 วัคซีนป้องกันโควิด-19 ของ GAVI มีการตรวจสอบขวดวัคซีนเพื่อแจ้งเจ้าหน้าที่สาธารณสุขว่าวัคซีนได้รับการจัดเก็บอย่างเหมาะสมและไม่ได้สัมผัส ความร้อนสูงเกินไป ผลที่ได้คือความเสียหาย GAVI รายงานเมื่อวันที่ 14 พฤษภาคม พ.ศ. 2564 ฉลากอัจฉริยะที่ผลิตโดย Zebra Technologies และผลิตโดย Temptime Corporation ประกอบด้วยวงกลมที่มีสี่เหลี่ยมสีอ่อนกว่าอยู่ตรงกลาง ทำจากสารเคมีไม่มีสีที่พัฒนาสีอย่างถาวรเมื่อเวลาผ่านไป . ซึ่งจะเข้มขึ้นเพื่อให้เห็นภาพของการได้รับความร้อนสะสม เมื่อขวดได้รับความร้อนเกินช่วงการจัดเก็บที่เหมาะสม สี่เหลี่ยมจัตุรัสจะมีสีเข้มกว่าวงกลม ซึ่งบ่งชี้ว่าวัคซีนไม่ควรใช้อีกต่อไป
ยาแห่งชาติ BBIBP-CorV COVID-19 ห้องสมุดยาวัคซีน ทะเบียนห้องสมุด: DB15807